目的
糖尿病モデルとしてはマウス・ラットなどの小動物を用いた薬物誘発性或いは遺伝子改変モデルが利用されている.しかし,人工膵臓などのデバイスの開発には小さすぎるため,大型動物における糖尿病モデルが望まれている.そこで,今回ミニブタを用いたストレプトゾトシン誘発糖尿病モデルの開発を試みた.
方法
ゲッチンゲンミニブタ オス
12ヶ月齢
メデトミジン/ミダゾラムを筋肉内投与することによりブタを鎮静化し,イソフルラン麻酔下で経皮的にCVカテーテル留置を行なった.生理食塩液を用いて1%濃度になるように調製したストレプトゾトシン(以下,STZ)を留置したカテーテルを通して75或いは80mg/kgになるようにシリンジポンプを用いて投与した.また,この留置したカテーテルは血糖値測定用の採血カテーテルとしても利用した.
STZ投与当日を0dayとし,血糖値の測定はSTZ投与前(Pre),その後7dayまで毎日1回,給餌前にカテーテルより採血し,空腹時血糖値の測定を行った.
なお0dayは絶食とし,1dayから通常の給餌を再開した.
結果
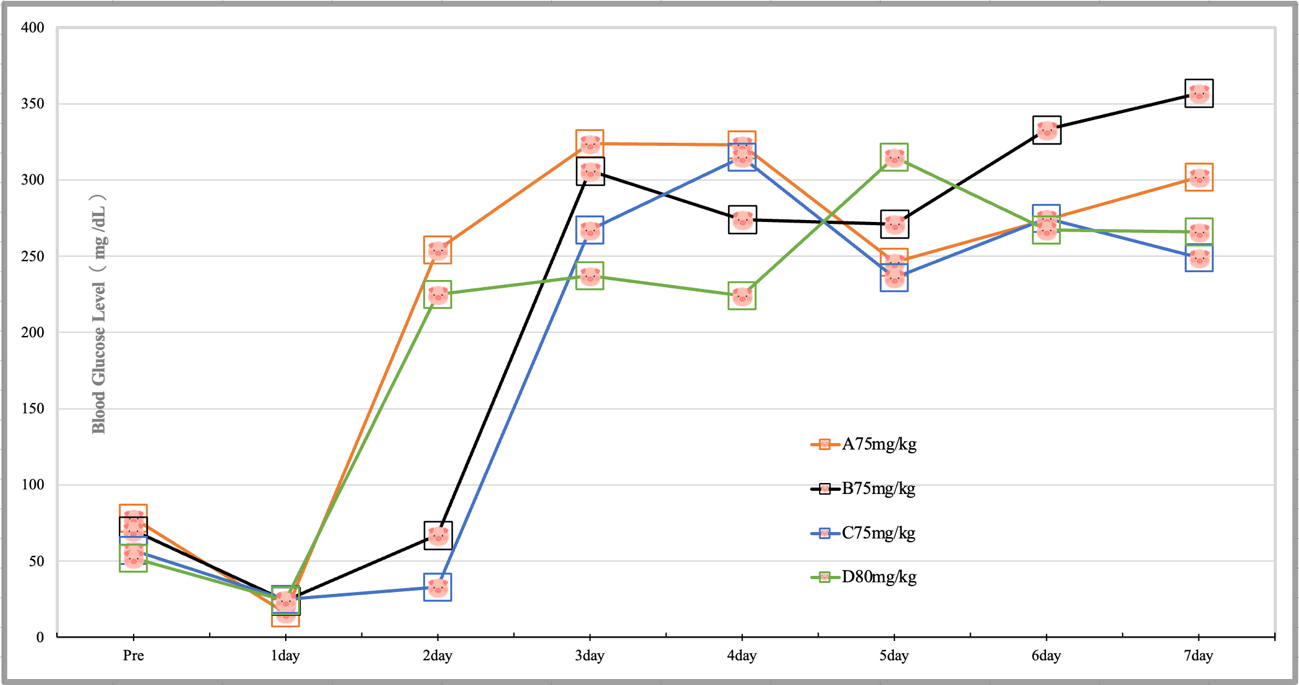
血糖値の変動を図に示す.
血糖値はいずれの動物も1dayではPre値よりも下がり,その後2dayから上昇した.3dayではすべての動物で明確な血糖値の上昇が認められ,7dayまで250~350mg/dlの範囲で安定した高い血糖値を示した.また,ストレプトゾトシンの75mg/kgと80mg/kgの間では明確な差は認められなかった.
高血糖化後の一般状態として,多飲多尿の症状が観察されたが,その他に異常は認められなかった.
まとめ
今回,大動物の糖尿病モデルを作製することを目的にミニブタにストレプトゾトシンを投与した.その結果,安定した高血糖を示し,糖尿病モデルの作製に成功した.
ブタに糖尿病を作製する場合のストレプトゾトシンの用量は多くは150mg/kgの単回投与或いは50mg/kgの3回投与などが報告されている.しかし,今回75或いは80mg/kgの単回投与により高血糖のモデルが作製できることから,STZによる高血糖に起因しない副作用等を抑制することが可能になり,モデル作製の費用も抑制することが可能となった.
全ての動物で1dayの血糖値が下降したことについては,Pre値測定時には鎮静剤としてメデトミジンの影響があり,通常よりも高い血糖値を示していたと考えられる.またSTZによるβ細胞の破壊によって,貯蔵されていたインスリンが放出されるとの報告があり,その影響により,一過性に血糖値が下がった可能性もあり得る.しかし,今回のSTZの用量が低いことを考慮すると,1dayではSTZによるβ細胞の破壊がまだ進んでおらず,通常の空腹時血糖値を示していると思われる.
本試験において75mg/kgと80mg/kgでは一般状態,および血糖値に差はなく,過去の実験においては,75mg /kgでは17day以降に血糖値が下降し始め,Pre値まで下がる個体が一定数認められたが,80mg /kgではこの現象は起こっていない.このことから長期間安定した高血糖を維持するにはSTZの投与量は80mg /kgが必要と考えられる.
また,ブタの血糖値を測定する場合,鎮静下,麻酔下或いは拘束下で血液を採取する必要があり,鎮静・麻酔下だと鎮静薬や麻酔薬の影響,拘束の影響により,血糖値が上がる傾向があるが,本試験のように採血用のカテーテルを留置して無麻酔・無拘束で採血を行うことにより,血糖値の変動を抑えることも可能である.
以上のことから,本試験の手法により,STZの用量を下げることにより,副作用,費用を抑制するとともに安定した血糖値を示めすモデルの作製が可能となり,今後糖尿病に関するデバイスの開発,糖尿病治療薬の開発に繋がるモデルとして利用できる.
自社開発技術の紹介
小動物
慢性腎不全モデルラットの作製
-腎動脈分枝結紮法-
マウスを用いた耐糖能試験
-OGTT-
坐骨神経切除による腓腹筋,
ヒラメ筋,足底筋に対する影響
慢性腎不全モデルラットの作製
-アデニン誘発慢性腎不全モデル-
デキストラン硫酸ナトリウム誘発
潰瘍性大腸炎モデルの作製
マウスの無麻酔経時採血方法の検討
‐頚静脈(鎖骨下静脈)‐
経口脂質負荷試験(OLTT)を用いて
新規肥満・糖尿病マウス作製法を用いた
肥満・糖尿病予防効果(特許出願中)
新規肥満・糖尿病マウスの作製(特許出願中)
慢性腎不全モデルマウスの作製
‐アデニン誘発慢性腎不全モデル(1)‐
慢性腎不全モデルマウスの作製
‐アデニン誘発慢性腎不全モデル(2)‐
大動物
低用量STZ誘発性糖尿病
モデルブタの作製


 お問合せ
お問合せ